2 新規ドラッグデリバリーシステム(DDS)に関する研究
我々は,抗体医薬,RNAiなどの生体分子医薬の細胞内送達を増強するためこれらの生体分子と同様なpH応答機能とエンドソーム放出活性を示すbio-mimic(生体模倣性)な機能性ポリマーを設計してきた。機能性ポリマーをナノ粒子に組み込むことにより刺激応答性・抗体感受性・生体親和性などを付与したナノサイズの"インテリジェント"なDDSデバイスを作製することが可能である。
温度応答性ナノキャリアの開発
機能性高分子poly-N-isopropylacrylamide (PNIPAAm) は水中での温度刺激に応答し,32℃より低温側では水に溶解し水和伸展状態,高温側では水に不溶となり脱水和収縮状態と構造変化を起こす温度応答性高分子として知られている。この親水/疎水性の相変化は可逆的かつ迅速であり,相変化を起こす温度Lower Critical Solution Temperature (LCST)は,高分子の分子設計により自由に制御することができる。PNIPAAmはLCST以下で親水性を示すため,リポソームなどのナノ粒子に導入することで外側に水和層を形成し,肝臓や脾臓などの細網内皮系組織による取り込みを回避して血中滞留性を向上させることが期待できる。導入した高分子は,リポソームの封入率の向上に寄与しており,さらに温度を上昇させることによって内封した薬物を放出するという温度応答性の薬物放出が可能であった。ナノ粒子は,腫瘍集積性の向上を目的として100 nm程度のサイズに調製している。PNIPAAmを導入すると封入率の向上やリン脂質同士の凝集が回避できることが確認された。これは機能性高分子を導入することによりナノ粒子の外側の高分子鎖が安定な水和層を形成するためと考えられる。
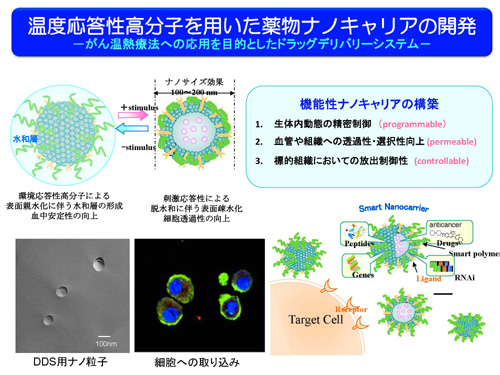
がん細胞への効果
ヒト大腸がん由来のCaco-2細胞等を用いて抗がん剤イリノテカンのリポソームからの放出とその効果について, LCSTが41℃となるよう設計したP(NIPAAm-co-DMAPAAm)を用いて培養温度を37℃と42℃とで比較したところ,37℃に比べ42℃では強い殺細胞作用が確認された。これら結果は,この合成した共重合体高分子のLCSTが41℃付近であり,37℃では高分子鎖に変化が起こらないためナノ粒子は比較的安定であるが,42℃では高分子鎖が収縮することで疎水性となりナノ粒子外側の水和層が減少し,膜を安定化する力が弱まり,内封した薬物が放出されたためと考えられる。これにより温度応答性ナノ粒子はLCSTに応じた温度応答性の薬物放出制御が可能であることが確認された。抗がん剤使用時に温熱療法と併用することにより,副作用の少ない抗癌剤の適正使用が期待できる。温度以外に,pHに応答する機能性高分子を用いて生体分子との相互作用を制御することに成功しており,今後は,pH応答機能とエンドソーム放出活性を備えたナノ粒子によるドラッグデリバリーの実現に向けて検討を進めている。



